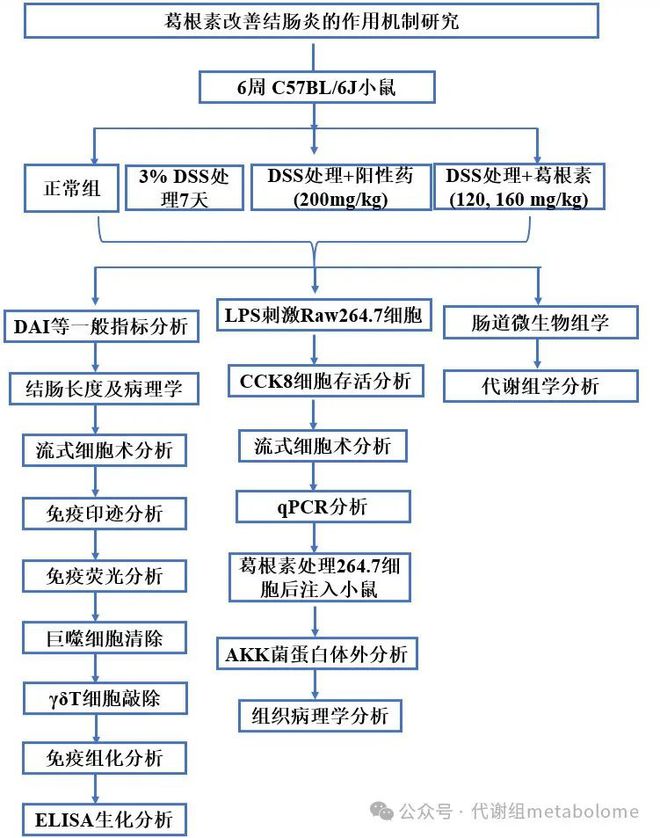
龙8long8,中药单体1区-南大南中医:葛根素通过调节肠道菌群和代谢且直接抑制
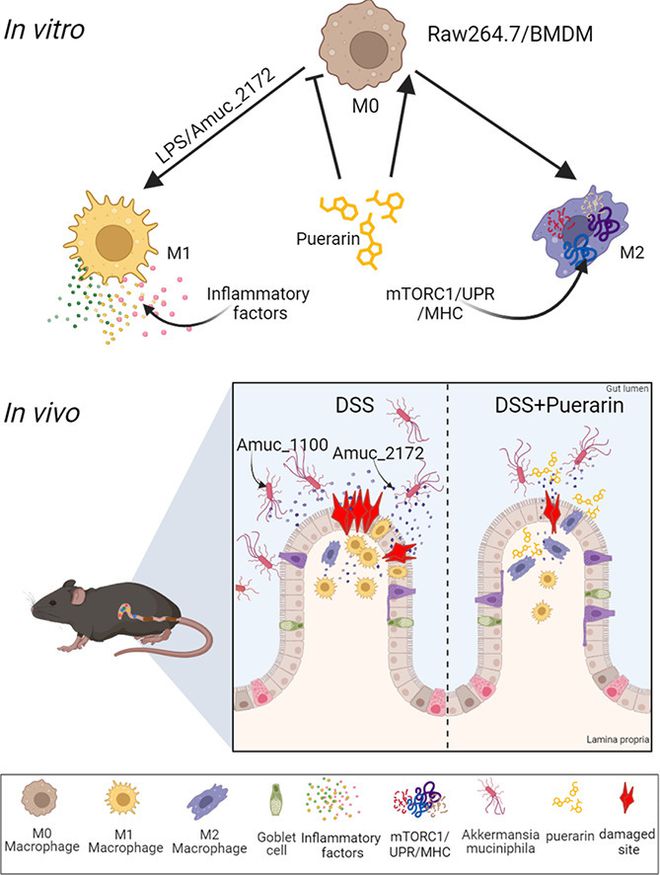
溃疡性结肠炎(UC)是一种主要影响结肠和直肠的炎症性肠病。UC的临床症状包括持续腹泻、腹痛和直肠出血,慢性炎症通常仅限于结肠的黏膜层。巨噬细胞在UC的发病机制中起着重要作用,这是由于肠道微生物群的存在。葛根素是一种活性化合物,来源于葛根,一种传统的中草药,在各种疾病和疾病模型中表现出强效的抗炎特性,包括小鼠的UC样结肠炎。然而,该分子如何通过重新极化巨噬细胞在结肠炎中达到治疗效果仍然尚不清楚。本研究利用体内和体外实验方法以及多组学分析,旨在阐明葛根素靶向巨噬细胞治疗结肠炎的潜在机制。葛根素的抗炎作用通过H&E染色、qPCR、ELISA、免疫印迹和免疫荧光等分子和组织学检测进行了评估;通过体内成像、免疫荧光、蛋白质印迹、qPCR和PAS染色测量肠道通透性参数;通过CCK8、流式细胞术和qPCR在体外检测葛根素对巨噬细胞的直接影响;此外我们还对肠道内容物进行了16S rRNA测序和代谢组学分析,鉴定了关键致病菌群,并在体外和体内进行了验证。结果表明,葛根素在体外对巨噬细胞的M1样极化具有直接的抑制作用,这足以改善DSS小鼠的结肠病变和全身炎症。葛根素还降低了肠道中嗜黏蛋白阿克曼菌的丰度。进一步的研究表明,葛根素有效地抑制了由嗜黏蛋白阿克曼菌分泌的Amuc-2172蛋白诱导的M1样巨噬细胞活化,从而改变了DSS模型病变。数据表明,DSS结肠炎的发病机制是由宿主细胞对有毒外来分子和肠道微生物群的反应介导的,葛根素靶向巨噬细胞等特定细胞群具有潜在的治疗作用。
我们最初进行了一项实验,以评估葛根素(化学式如图1A所示)在DSS诱导的小鼠结肠炎模型中的治疗效果(图1B)。DSS组的小鼠体重明显减轻(图1C)。此外,这些小鼠出现了严重的结肠炎,疾病活动指数(DAI)评分升高(图1D)、结肠长度缩短(图1E)和实质性组织病理学病变(图1G)证明了这一点。qPCR检测到结肠组织中IL-6和IL-1β的炎性细胞因子水平升高(图1F),表明了局部炎症。这得到了蛋白质印迹分析的支持,该分析显示iNOS、IL-1β、TLR2和磷酸化NF-κB p-p65的水平升高(补充图1A&B)。此外,DSS导致脾脏明显增大(图1H),ELISA分析确定循环中IL-6和IL-1β水平升高(图1I),表明全身免疫改变。与NC小鼠和阿司咪唑(200mg/kg)处理的小鼠相比,葛根素处理,特别是160mg/kg的剂量,显著改善了DSS组中所有病理表型(图1C-H)。因此,160 mg/kg剂量的葛根素在改善DSS结肠炎方面是安全有效的。RT-PCR引物如表1所示。
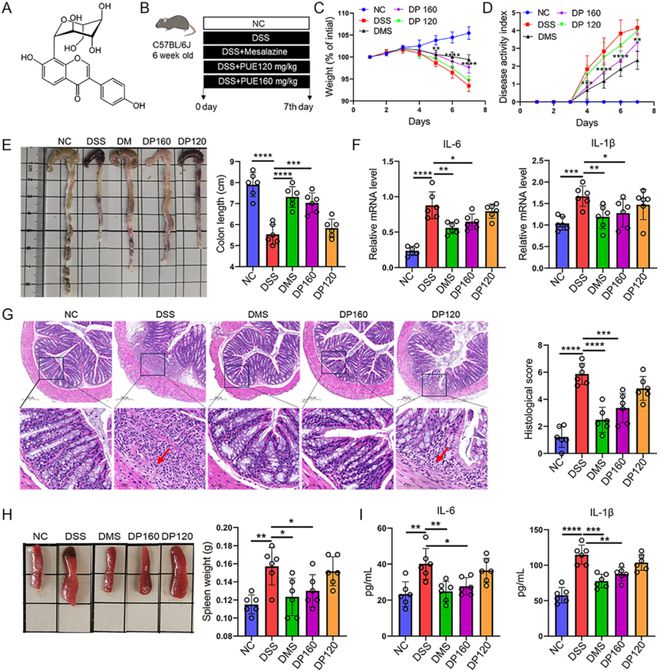
图1 葛根素改善了DSS小鼠的全身和局部表型。(A)葛根素的化学结构。(B)实验的示意图。(C&D)体重和疾病活动指数(DAI)曲线。(E)结肠的代表性形象。(F)qPCR检测IL-6和IL-1β的mRNA水平。(G)结肠的H&E染色。比例尺=200µm。箭头指向肠道炎症损伤的部位。(H)脾脏的代表性图像。(I)ELISA法测定小鼠眼血清中IL-6和IL-1β的水平。数据以平均值±标准差表示,n=6,*P0.05,**P0.01,***P0.001,****P0.0001。
为了评估肠道屏障功能,我们进行了FITC-D渗漏研究。与NC组相比,DSS处理的小鼠中检测到FITC-D泄漏显著增加,这是在施用荧光染料四小时后通过体内成像确定的。葛根素(160 mg/kg)显著降低了体内图像中泄漏荧光的强度和面积(补充图1C-D)。相应地,qPCR证实了渗透性相关基因Occludin和ZO-1表达的减少(补充图1E)。为了阐明DSS结肠炎中肠漏与上皮完整性之间的联系,我们在相同的实验背景下观察了Occludin。DSS严重破坏了正常的上皮形态,显著降低了Occludin的表达,并破坏了其膜结合,如免疫荧光所示(补充图1F)。葛根素可显著逆转这些作用。
此外,如免疫印迹分析所示,DSS小鼠的结肠中IL-17受体衔接蛋白Act-1和IL-17RC的蛋白质水平显著降低(补充图1G),这两种蛋白是上皮细胞内IL-17/Act-1信号传导的关键参与者,对维持屏障功能和调节Occludin的表达和定位至关重要。葛根素有效地逆转了这些减少。最后,PAS染色,也称为杯状细胞染色,显示了上皮结构的显著丧失,表现为DSS小鼠结肠病变中杯状细胞的丧失(补充图1H&I)。葛根素恢复了上皮结构,包括杯状细胞的存在,这与Klf4和Muc2的表达一致(补充图1J)。
我们旨在鉴定参与DSS诱导的结肠炎的关键免疫细胞。流式细胞术分析显示,与NC小鼠相比,DSS小鼠的MLN中CD4+T细胞、γδT细胞和巨噬细胞显著增加。葛根素显著减少了巨噬细胞数量,而CD4+T细胞保持不变,γδT细胞显著增加(图2A)。此外,巨噬细胞在结肠炎患者和DSS小鼠的结肠组织中显著富集(图2B)。葛根素显著降低了DSS小鼠结肠中巨噬细胞的存在。
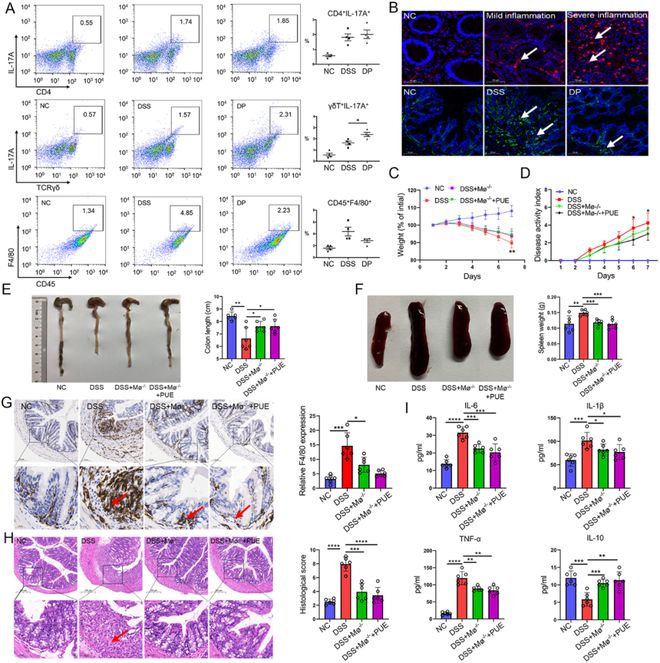
图2 葛根素的治疗作用需要巨噬细胞。(A)通过流式细胞术分析NC、DSS和DP组MLN中Th17细胞、γδT细胞和巨噬细胞的比例。(B)人和小鼠结肠组织中F4/80的免疫荧光染色。比例尺=50μm。箭头指向肠道中巨噬细胞富集的区域。(C-D)试验小鼠的体重和疾病活动指数。(E-F)结肠长度和脾脏外观的代表性图像。(G)巨噬细胞清除小鼠结肠的F4/80免疫组织化学染色。比例尺=100µm箭头指向肠道中巨噬细胞富集的区域。(H)巨噬细胞清除小鼠结肠组织的H&E染色,比例尺=200µm。箭头指向肠道炎症损伤区域。(I)通过ELISA测定小鼠眼血清中IL-6、IL-1β、IL-10和TNF-α的水平。数据表示为平均值±标准差,n=6,*P0.05,**P0.01,***P0.001,****P0.0001。
由于CD4+T细胞(Th1和Th17细胞)是促炎细胞,参与促进结肠炎病变,并且在目前的研究中没有被葛根素减少,这表明葛根素通过直接调节T辅助细胞来改善DSS结肠炎的效果不太可能。相反,它可能通过促进在结肠炎中具有保护作用的γδT细胞,或通过下调巨噬细胞,或两者兼而有之来发挥作用。为了区分这两者,我们通过敲除γδT细胞(TCRδ-/-)消除了结肠炎背景下的γδT淋巴细胞。如TCRδ-/-所示,DSS诱导了更严重的结肠炎,结肠长度进一步缩短和更严重的组织病理学病变证明了这一点(补充图2A&B)。DSS在结肠病变中引发了巨噬细胞和中性粒细胞更集中的侵袭(补充图2C&D),而葛根素大大减少了具有TCRδ-/-的DSS小鼠的结肠炎病理和炎性细胞侵袭,表明γδT细胞以外的细胞也参与其中。
为了测试巨噬细胞在介导葛根素改善结肠炎中是否更为重要,我们建立了一个巨噬细胞耗竭模型。结果显示,与DSS小鼠相比,DSS+Mø-/-小鼠的结果有所改善,包括体重增加、DAI指数降低、结肠组织中F4/80表达减少、结肠长度增加和脾脏体积减少。巨噬细胞清除后给予葛根素并没有进一步改变疾病表型(图2C-G),表明葛根素的益处主要通过巨噬细胞介导。组织切片显示,与DSS组相比,DSS+Mø-/-和DSS+M-/-+PUE组的结肠病变也有类似的减少(图2H)。血清炎症因子反映了这些病理结果,在DSS小鼠中显示出M1样细胞因子模式,这可以通过使用或不使用葛根素的巨噬细胞耗竭来逆转(图2I)。这些结果表明,巨噬细胞是DSS结肠炎中介导葛根素治疗作用的关键致病成分。
为了研究葛根素是否直接作用于巨噬细胞,我们进行了一项体外研究。CCK8检测表明,葛根素浓度为20µM或更低时,对细胞存活率没有影响(图3A)。然后,我们使用LPS在Raw264.7细胞中建立了M1样炎症模型,以模拟体内DSS小鼠模型。流式细胞术分析显示,LPS处理的Raw264.7细胞中CD80显著上调,对CD206的影响很小。葛根素通过以浓度依赖的方式显著下调CD80来减轻LPS诱导的细胞炎症,对CD206没有明显影响(图3B)。LPS处理显著增加了促炎基因iNOS和IL-6的表达,同时降低了抗炎基因Arg1的表达。葛根素显著逆转了这些基因表达的变化(图3C)。
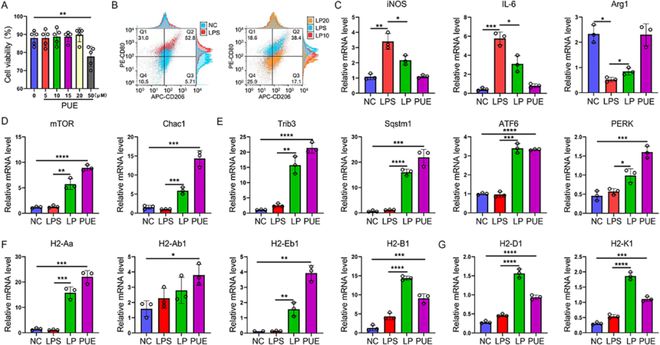
葛根素显著刺激了mTORC1信号基因mTOR、Chac1和未折叠蛋白反应(UPR)基因PERK、Sqstm1、Trib3和ATF6,而与LPS的存在无关(图3D-E)。因此,葛根素不仅可以对抗LPS诱导的巨噬细胞炎症基因表达,还可以通过促进mTORC1信号传导和UPR基因表达来预处理细胞的应激反应。此外,葛根素显著增加了MHCII基因H2Aa、H2-Ab1、H2-Eb1和H2-B1以及MHCI基因H2-D1和H2-K1的表达,与LPS处理无关(图3F-G)。这表明葛根素增强了与炎症调节和免疫平衡相关的巨噬细胞功能。
我们使用体外葛根素处理或未处理的Raw264.7细胞评估了葛根素预处理巨噬细胞在结肠炎中的作用。在DSS结肠炎中,与DSS组相比,输注Raw264.7细胞的小鼠(DR小鼠)表现出进一步的体重减轻、DAI评分增加和结肠长度缩短。相反,输注葛根素处理的Raw264.7细胞的小鼠(DRP小鼠)在体重、DAI指数和结肠长度方面显示出显著改善(图4A&B,图D)。病理分析显示,与DSS组相比,DR组的炎性细胞浸润和组织损伤更为严重,而DRP组在各种表型上都有显著改善(图4C)。ELISA证实DRP小鼠循环中IL-1β、TNF-α和IL-6减少,IL-10增加(图4E)。我们使用骨髓源性巨噬细胞(BMDM)的实验在各个水平上证实了这些发现(图4F-I)。
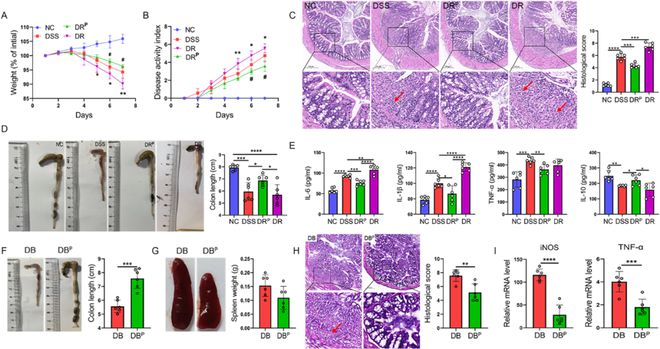
图4 葛根素预处理的巨噬细胞具有抗结肠炎作用。(A-C)输注有/没有葛根素处理的Raw264.7细胞。展示了受试小鼠的体重和DAI曲线,以及结肠H&E染色的代表性图像。比例尺=200µm。箭头指向肠道炎症损伤区域。(D)展示了受试小鼠结肠长度的代表性图像。(E)通过ELISA法测定小鼠眼血清中IL-6、IL-1β、TNF-α和IL-10的水平。(F-H)BMDM细胞输注研究。结肠、脾脏和结肠组织H&E染色的代表性图像,比例尺=100µm。箭头指向肠道炎症损伤区域。(I)qPCR检测BMDM输注后结肠组织中iNOS和TNF-α的含量。数据表示为平均值±标准差,n=6,*P0.05,**P0.01,***P0.001,****P0.0001。
接下来,我们利用Tax4Fun2分析了KEGG通路,并预测了DSS和葛根素给药小鼠的肠道微生物群的功能,包括细胞过程、生物系统、环境信息处理、人类疾病和代谢。在细胞过程中,DSS增加了细菌的趋化性和鞭毛组装,而葛根素显著减少了肠道微生物群的这些过程龙8long8。此外,葛根素大大增加了大肠杆菌和铜绿假单胞菌的生物膜形成(补充图3A)。因此,葛根素保护肠道免受肠道生态失调的致病条件。在生物体系统中,葛根素减少了心肌收缩和植物-病原体相互作用,但显著增加了胰高血糖素信号通路、脂质代谢通路和产热(补充图3B)。在环境信息处理中,葛根素抑制了DSS诱导的FoxO信号通路、MAPK信号通路、磷脂酶D信号通路和细菌分泌系统(补充图3C)。重要的是,在人类疾病中,葛根素降低了幽门螺杆菌感染和军团菌病的上皮细胞信号传导。它还减少了帕金森病、阿尔茨海默病、亨廷顿氏病以及肌萎缩侧索硬化症和非酒精性脂肪肝的影响,而所有这些都会被DSS显著增强(补充图3D)。这些发现表明,葛根素对肠道微生物群的组成具有广泛的有益作用,可以减少DSS相关肠道生态失调引起的炎症和神经元毒性倾向。
此外,通过分析DSS诱导的肠道微生物群功能变化,PUE进一步逆转了这种变化,我们发现代谢重编程是各组之间的主要差异。与NC相比,DSS中的各种氨基酸生物合成途径,包括支链氨基酸和芳香族氨基酸生物合成,多种脂质代谢途径,包括花生四烯酸代谢,特别是脂多糖生物合成,都得到了增强,而PUE显著减少了这些过程。与此同时,青霉素和头孢菌素、万古霉素类抗生素、四环素的生物合成以及初级和次级胆汁酸的生物合成、氯环己烷和氯苯的降解以及二甲苯的降解则相反。此外,DSS诱导后,PUE逆转了柠檬酸循环和氧化磷酸化(补充图3E)。这些发现总体上表明DSS小鼠的促炎肠道微生物群受到葛根素的广泛和强烈抑制。
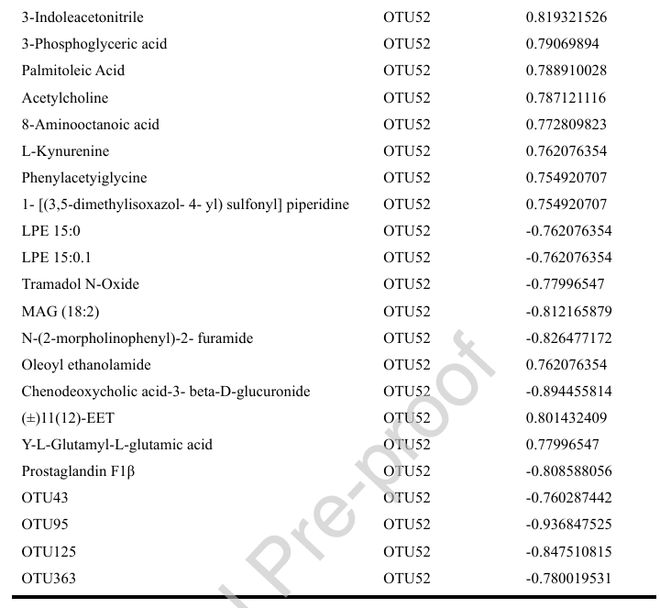
接下来,NC、DSS和DP组代谢物的正交偏最小二乘分析揭示了不同的模式(图5H)。差异代谢物的热图显示了各组之间的高低高或高低低模式(图5I)。trans组学分析突出了两个相反相关的模块(抗结肠炎或促结肠炎),每个模块都由许多不同的菌群和代谢物组成(图5J)。OTU52(阿克曼菌)是肠杆菌代谢物调节的核心,主要涉及脂肪酸代谢物、芳香族氨基酸、神经代谢物和其他化合物(图5K&L、补充图4和表2)。因此,嗜黏蛋白阿克曼菌可能在DSS诱导的结肠炎中起着至关重要的作用。
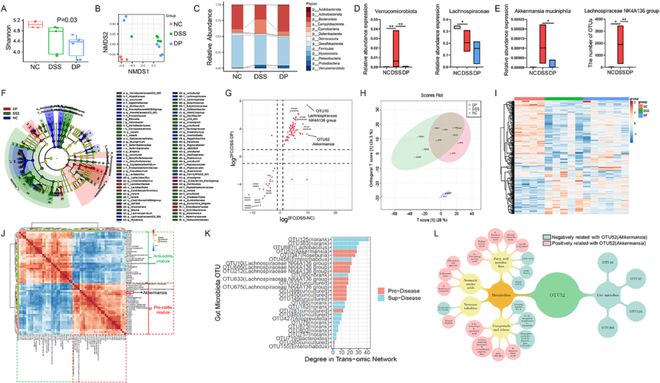
图5 葛根素调节DSS结肠炎小鼠的肠道微生物群和代谢。(A)细菌物种的α多样性。(B)NC、DSS和DP组肠道微生物群的NMDS分析。(C&D)门水平肠道菌群相对丰度图。(E)嗜黏蛋白阿克曼菌在p_Verrucomicrobiota中占主导地位。(F)使用LEfSe方法生成的分支图分析了对照组(蓝色)、DSS(绿色)和DSS+葛根素(红色)小鼠肠道微生物的系统发育分布。(G)OTU水平上肠道菌群差异的火山图。(H)NC、DSS和DP组的OPLS。(I)描绘NC、DSS和DP组中不同代谢物的热图。(J)肠杆菌-肠杆菌代谢产物trans组学相关性分析热图。(K)肠杆菌在trans组学分析中的程度。(L)嗜黏蛋白阿克曼菌相关OTU和代谢物的插图。浅蓝色表示与嗜黏蛋白阿克曼菌呈负相关,粉红色表示与嗜黏蛋白阿克曼菌呈正相关。数据表示为平均值±标准差,n=6,*P0.05,**P0.01,***P0.001,****P0.0001。

之前的研究已经证明了嗜黏蛋白阿克曼菌对肠道免疫的影响,但它与结肠炎的关系仍然不明确。葛根素是中药的重要成分,具有抗炎作用。我们研究了葛根素是否可以抑制嗜黏蛋白阿克曼菌相关的巨噬细胞M1极化,葛根素预处理的巨噬细胞是否可以改善DSS诱导的结肠炎。体外实验证实,嗜黏蛋白阿克曼菌的蛋白,特别是其分泌的Amuc-2172可显著诱导巨噬细胞M1极化(图6A-D)。Amuc_1100和Amuc_2172与LPS(LM组)组合可协同增加巨噬细胞M1极化状态。与NC、LPS、LAmuc_1100或LAmuc_2172组细胞相比,LM组细胞中炎性细胞因子IL-6、IL-1β、TNF-α和iNOS的表达增加,证明了这一点(图6E-H)。这些发现表明,A. muciniphila蛋白,尤其是Amuc-2172,模拟了细菌对巨噬细胞M1极化的影响(如LPS效应,但可能是通过不同的途径影响的)。葛根素显著抑制了LPS和/或A. muciniphila蛋白诱导的M1炎症反应。此外,给DSS小鼠输注经Amuc_1100、Amuc_2172或混合A. muciniphila蛋白刺激的Raw264.7细胞会加剧结肠炎,特别是用Amuc_2182刺激的巨噬细胞。与单独的DSS组相比,混合的A. muciniphila蛋白进一步加重了DSS结肠炎。葛根素在体外抑制了由混合A. muciniphila蛋白刺激的Raw264.7细胞的炎症作用,从而显著改善了结肠炎(图6I)。
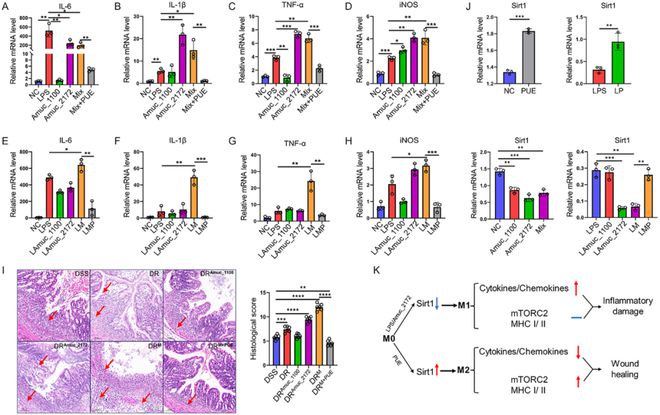
总之,这项工作发现,M0巨噬细胞被LPS或Amuc-2172激活为经典的M1状态,炎症基因的表达强烈上调,而葛根素刺激M0巨噬细胞进入以mTORC2和MHC基因高表达为特征的M2状态。这两组基因在表达调控方面是相互排斥的。因此,葛根素干预显著抑制促炎巨噬细胞并促进促修复巨噬细胞,这可能是MHC基因依赖性的。从机制上讲,之前有人提出,Sirt1的异位表达能够在体外逆转LPS诱导的Raw264.7细胞M1极化。为了进一步确定葛根素对巨噬细胞极化的体外作用潜在机制,我们检测了Sirt1的表达,并确实观察到葛根素对Sirt1表达的强烈诱导作用,这显著逆转了LPS和A. muciniphila蛋白对Sirt1表达的抑制作用(图6J)。图6K显示了结肠炎中葛根素巨噬细胞M2极化机制的示意图。
本研究探讨了葛根素对DSS诱导结肠炎的疗效及其机制。我们发现葛根素逆转了动物的局部和全身炎症病理,改善了DSS症状。进一步的研究表明,葛根素直接作用于巨噬细胞,抑制其M1极化,这足以对肠道病变产生治疗作用。根据体外试验,葛根素预处理诱导巨噬细胞M2极化,其特征是mTOR和MHC I和II基因的表达增加。
体内研究表明,虽然葛根素改善了DSS引起的炎症损伤,但它同时减少了巨噬细胞和中性粒细胞对结肠病变的局部浸润。巨噬细胞耗竭后UC表型的显著缓解,特别是在去除巨噬细胞后葛根素没有进一步减少UC病理,这表明葛根素的治疗作用是通过巨噬细胞介导的,这一点在之前的研究中没有提及。
体外研究表明,除了LPS诱导巨噬细胞M1极化外,嗜黏蛋白阿克曼菌分泌的蛋白Amuc_2172及其外膜蛋白Amuc_1100也显著诱导M1样极化增强(主要是通过Amuc_2182)。LPS和嗜黏蛋白阿克曼菌蛋白似乎对巨噬细胞M1极化具有协同作用,表明除TLR4以外的信号传导可能参与其中,TLR4被认为介导LPS诱导的巨噬细胞M1极化。重要的是,葛根素在体外能有效逆转LPS和Amuc-2172诱导的巨噬细胞M1样极化,表明其能够直接靶向巨噬细胞,改变其M1样表型极化,从而增强其对DSS结肠炎炎症的抑制能力。我们没有检测到DSS对巨噬细胞M1极化的任何影响,这表明DSS结肠炎病理可能需要额外的体内成分,如肠道微生物群。
巨噬细胞M1/M2极化是一种动态定义的现象。随着对疾病中个体化因素和特征的深入研究和考虑,可能会出现更微妙的理解,需要进一步调查,特别是通过使用组学和生物信息学分析工具。例如,在各种疾病中,包括器官和组织炎症,特别是在肿瘤研究中,单细胞测序分析通常可以将巨噬细胞分为许多簇。分析不同簇的单细胞表达谱可以进一步阐明巨噬细胞的特定功能,如促炎、促纤维化以及在疾病发病机制中具有凋亡和自噬功能的巨噬细胞。我们将在未来的研究中更深入地探讨这个方向。
从机制上讲,遗传易感性在UC中起着重要作用。主要组织相容性复合体(MHC)内的基因变异,特别是HLA-DRB1和HLA-DQB1的等位基因,白细胞介素-23受体基因的变异,以及在先天免疫信号传导和细菌病原体识别中起作用的含核苷酸结合寡聚化结构域的蛋白质2基因(也称为CARD15)的突变,都与UC风险有关。此外,参与调节免疫信号通路和维持肠屏障功能的蛋白酪氨酸磷酸酶非受体2型基因的变异以及参与细胞内病原体降解的自噬相关的16-样基因1也与UC易感性有关,表明存在多基因遗传模式。UC中的这些遗传缺陷揭示了广泛涉及的分子过程,从先天免疫反应到适应性免疫反应及其复杂的关系。研究表明,饮食、吸烟和微生物失调等环境因素会引发遗传易感个体的疾病。
据推测,但也有大量证据支持,遗传易感性会导致一种复杂的免疫状态,这是由引发结肠炎症反应的环境因素引发的,其特征是UC中以巨噬细胞为中心的两个事件。首先,巨噬细胞M1极化后,与中性粒细胞一起放大局部炎症和损伤。其次,M1巨噬细胞触发T辅助细胞在Th1细胞(IFN-γ)和巨噬细胞之间建立相互激活的恶性循环,并刺激Th17(IL-17)促进各种细胞释放MMPs,龙8网页版登录官网导致细胞外基质和肠道屏障的破坏,从而维持慢性炎症和组织损伤。在此背景下,葛根素通过直接将巨噬细胞锁定在M2极化中,借助巨噬细胞中高表达的MHC分子,一方面抑制局部炎症和损伤,另一方面促进伤口愈合。这一观点得到了抗炎天然产物研究的广泛支持。该模型需要许多可测试的实验,包括但不限于如何明确定义巨噬细胞M1和M2状态下的特性,以及组织相容性在排斥受损细胞和重建正常组织中的双重作用。基于上述论点,葛根素可靶向巨噬细胞并调节巨噬细胞极化特性。本研究还为结肠炎的免疫靶向治疗材料的设计提供了进一步的见解。
DSS结肠炎研究的另一个方面是研究肠道菌群变化及其作为UC的环境致病因素。首先,DSS可以分布在整个肠道,但主要引起结肠炎,这表明这些分子可能不会直接伤害上皮细胞。因此,肠道微生物群似乎是DSS和肠道病变之间的合理媒介。众所周知,结肠炎期间肠道微生物群发生了显著的生态变化。因此,仔细考虑微生物变化在结肠炎中的作用至关重要。鉴于肠道微生物群的显著个体差异和人群分布的异质性,在解释某些菌群和UC病变的病理相关性方面存在困难。动物实验可能因为同一研究中仪器设施的差异和不同研究之间的异质性,从而产生不一致的发现。例如,在我们的研究中,我们观察到嗜黏蛋白阿克曼菌的显著富集,这是一种目前引起人们关注的重要菌群,是治疗UC和CD的关键治疗靶点,我们展示了嗜黏蛋白阿克曼菌分泌蛋白的潜在危害。在人类IBD和模拟动物模型中,嗜黏蛋白阿克曼菌的变化不一致,这可能反映了肠道菌群多生态系统特性可能导致巨噬细胞M1极化。我们将在进一步的研究中详细阐述这些问题。然而,无论在何种情况下,都需要结合局部炎症状态和巨噬细胞功能来讨论肠道微生物群平衡和致病性的变化。从这个意义上说,我们对菌群变化及其病理影响的理解具有至关重要的基础意义。
总之,我们的研究结果强调了葛根素治疗结肠炎的潜在益处。葛根素通过逆转炎症病理来发挥作用,包括直接靶向巨噬细胞并调节其极化方向。这些机制有助于我们理解结肠炎的发病机制和病理进展,表明葛根素可能是治疗炎症性肠病的潜在药物。