龙8long8,狂奔的AI制药如何追赶?
: 前几天,世界人工智能大会(WAIC)在上海举办,刷屏网络,攻占心智,人工智能 (AI) 和机器学习 (ML) 仿佛无所不能,成为家喻户晓的时髦技术,当然在药物发现领域也必然的受到了生物技术和大型制药公司的吹捧。
目前,一些人工智能设计的候选药物已经进入临床(这个咱们之前的文章写过)。投资人对该领域也是摩拳擦掌,频频加注,这个领域已经成为最具吸引力的投资选择!
一切看上去都是顺风顺水的,这是真的未来,还是问题出现的前夜呢?不懂AI的,是不是就会被取代?如果要跟上这个时代,该怎么去追赶?
我也在很焦虑的学习,最近看了些文章和资料,今天就通过写文章的形式来梳理一个大概的脉络,希望对大家有帮助。
对于制药公司来说,将药物推向市场是一项费时费钱的工作,传统的药物开发时间线 位的生物制药公司的平均研发成本为每种药物 22.84 亿美元,其中约三分之一用于药物发现阶段,该阶段可以持续 5-6 年,然后候选药物进入临床。
因此,旨在避免在药物发现早期阶段进行耗时实验的AI可以大大简化药物发现过程,提高成功获得和实现药物批准的可能性。
在药物发现中使用AI并非新鲜事,1981年《财富》杂志就提出了计算机辅助药物设计(CADD)是下一次工业的口号龙8long8。同样的, 机器学习 (ML) 也不是什么新鲜事物。1994 年,QSAR建模作为一种通过从化合物的聚焦子集推导方程来预测表型效应(如毒性)的方法建立。
AI、ML 和深度学习(DL) 这些术语通常混用,但有必要单独进行定义。人工智能是一个总称,指的是使用技术来构建能够模仿与人类智能相关的认知功能的机器和计算机,在药物发现的背景下分析数据和提出建议。而机器学习是人工智能的一个组成部分,它自动使机器或系统在训练的过程中进化。深度学习又是机器学习的升级版本,它用更复杂的人工神经网络通过各种算法层处理数据,并在没有人为干预的情况下做出判断。
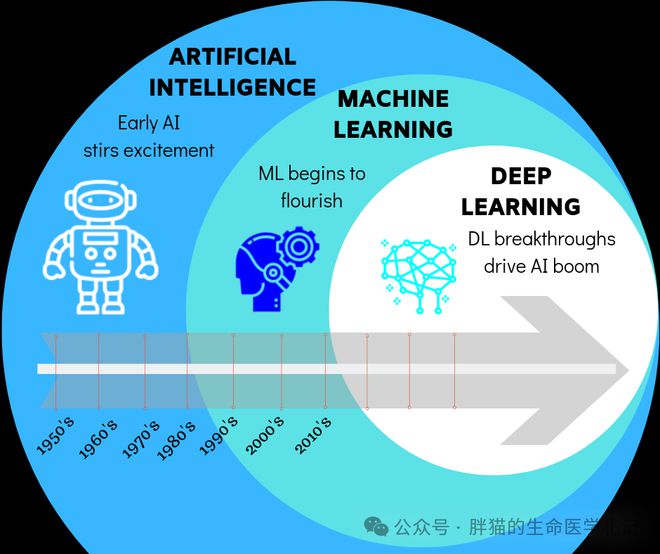
在过去的十年中,AI制药飞速发展,2012至2018年,人工智能训练运行中使用的“计算能力”呈指数级增长,3.4个月翻一番,相当于30万倍的提升。现在,药物发现的几乎每个阶段都有相关的AI工具,并且成果现已开始显现。
靶点识别是药物发现中至关重要的步骤,每一步的成功率都会受其影响。它涉及靶点蛋白或细胞通路识别。多组学(如基因组学、表观基因组学、蛋白质组学)与实验和计算方法的结合构成了靶点识别的基础。 但对疾病机制研究和患者来源的数据分析是一项极其复杂的任务,尤其是对机制知之甚少的复杂疾病。除了复杂的多组学数据处理方法外,人工智能图像识别算法也已在靶点识别中应用。
靶点确定后,需确定靶点的结构来进行候选化合物设计。但获得蛋白-配体的3D结构并不简单,常需X射线晶体学和冷冻电子显微镜 (cryo-EM) 等技术。这些技术有局限性,一些不易结晶的蛋白或太小的蛋白很难被解析。
药化专家如果提前知道靶点结合的位点,就可以通过合理的结构数据支持新的分子设计。 在过去几十年里,实验解析的蛋白结构超过了二十万个,几乎涵盖了所有蛋白质类别。在这个角度,AI就可以起到大作用了,例如Google Deepmind通过数十万个蛋白质结构和序列进行算法训练建立了AlphaFold2模型, 可以准确地预测氨基酸序列的结构。
传统的高通量会针对给定靶点筛选 50,000 - 500,000个级别的化合物库,在二次验证后仅少量“命中”,这些天选之子还常表现出较差的亲和力、次优的 ADMET和PK特性。而整个过程则需要耗时数年才有可能得到PCC。
最近包含数十亿个可按需合成的分子库被用于虚拟筛选,如 Enamine Real Space、Mculule Ultimate 和 WuXi GalaXi,有力地促进了超高通量的药物筛选。 超大规模虚拟筛选解决方案的一个例子是Iktos,其正在开发的dockAI 平台准确率超80%。2023年3月,Iktos宣布完成1550万欧元的A轮融资。
候选药物的理化特性会对临床进展产生巨大影响。了解药物的PK/PD特征在临床中至关重要,但PK/PD特征通常难以预测和优化。 QSAR算法通常根据给定目标和化学支架获得的数据进行训练,可以指导亲和力和效力的优化。
人工智能辅助的从头设计可以生成更广泛的结构,而无需依赖预先存在的化合物库。2019 年,至少有九家人工智能技术提供商开始提供定制的从头药物设计服务。
然而,从头药物设计比虚拟筛选要复杂得多,截至2023年9月,只有 Insilico Medicine 的一款完全由人工智能设计的药物成功进入II期试验。 除Insilico 外,Exscientia 和 BenevolentAI 等公司也率先在端到端药物发现中使用生成式人工智能。Exscientia 在整个发现流程中使用AI,2023 年 9 月,默克和 Exscientia 签署了一项价值高达 6.74 亿美元的合作协议,以利用 Exscientia 人工智能驱动的精准药物设计和发现能力。
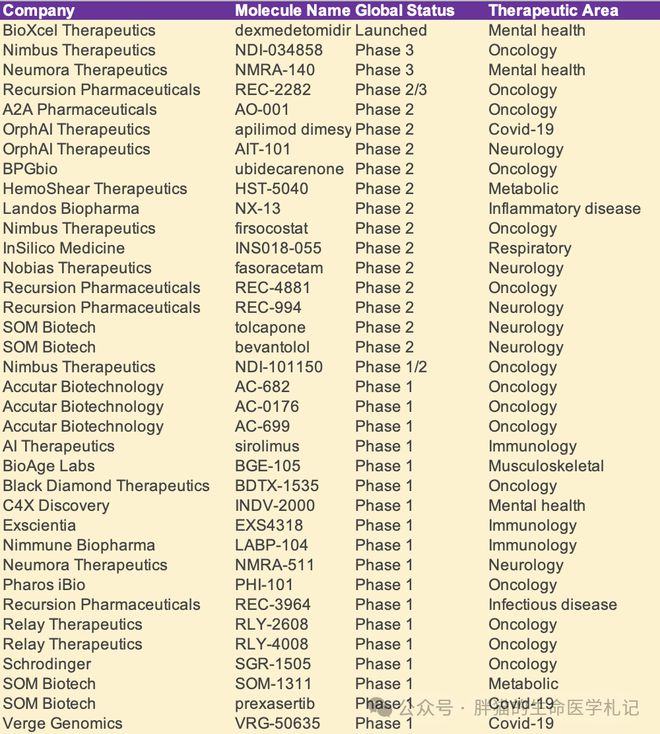
AI/ML 不仅在药物化学和药物设计方面受到关注,而且在药物再利用方面也受到关注,这一概念是将已批准或研究(包括临床终止)的药物扩展到新的治疗领域。
多家公司目前正在积极利用丰富的人类疾病组学数据在新的治疗领域重新定位药物。Pharos iBio 的Chemiverse平台结合了大数据和人工智能技术,将最初是作为急性髓性白血病 (AML) 疗法开发的小分子Phi-101,重新用于卵巢癌,该项目目前在I期试验中。 自2015年来,阿斯利康一直在开发重新利用药物的算法,并于2020年确定了由特发性肺纤维化 (IPF) 和 saracatinib 诱导的互补基因表达谱,saracatinib 是一种最初开发用于潜在治疗癌症的候选药物。saracatinib 治疗 IPF 的 1b/2a 期临床试验目前正在进行中,预计将于 2023 年底完成。Auransa 和 Healx 等其他较小的公司也在该领域比较活跃。
最近几年被称为“AI的春天”。在药物发现领域,AI已经显示出其在简化发现流程中耗时且成本高昂工作的能力,据估计人工智能驱动的药物发现可以节省至少 25-50% 的时间和成本,不过,目前尚不清楚AI制药能在多大程度上促进临床转化和进展。
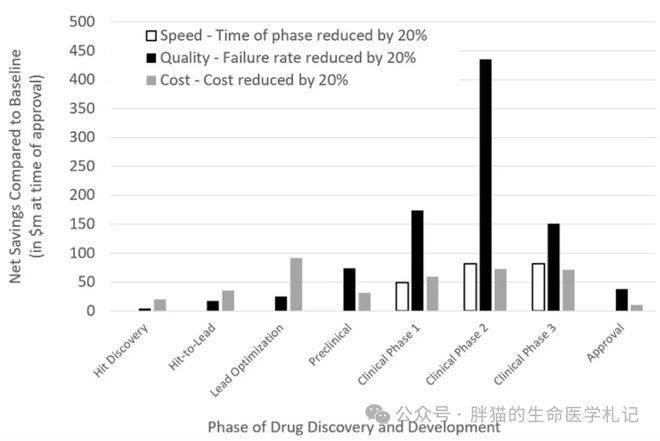
了解药物如何与靶点相互作用不仅是化学问题,而且还涉及蛋白质构象变化、细胞信号传导、基因表达、蛋白质修饰以及系统生物学的各个其他方面。将时间和空间维度添加到这些方面会使情况变得更加复杂。这种复杂性的结果是,为人工智能提供有意义的定量变量和数据变得非常具有挑战性。 未来人工智能在药物发现中的实施无疑将受益于日益丰富的患者数据及更多的临床前数据。随着数据广度和深度的增加,人工智能算法将更好地掌握潜在的疾病生物学,并更好地预测患者的结果。
在药物发现过程中,人工智能已经证明了其显着提高生产力和扩大分子多样性的能力。还有待观察的是人工智能衍生药物是否能够实现临床的改善和更高的临床成功概率。
这种挑战,一方面是源于AI 技术本身的发展速度太快,需要我们不停“充电”、学习,时常使人觉得难以追越的同时也难以掌控;另一方面是由于AI 药物设计是多学科的交叉融合,龙8long8手机登录需要干湿实验的闭环以进行迭代优化。
想要深度学习了解AI制药的方方面面,通过看碎片化的信息,我自己感觉是远远不够的,龙8long8手机登录需要通过借由相关工具来帮助建立系统性认知,那今天给大家推荐一个工具——
, 这本书详细介绍了AI如何加速药物发现、优化研发流程以及提升临床试验的效率。 无论您是科技爱好者、医药专业人士,还是对未来充满好奇的读者,这本书都将为您展示一个崭新的视角。点下方链接可直达。